Лекция II. Физика воды для инженеров и механиков
ГК Гидросервис любит радовать своих покупателей не только приятными акциями и плюшками, но и интересным, познавательным материалом для размышления и чтения. Мы продолжаем публиковать научно-популярные статьи, написанные Когтевым Н.В. Они написаны настолько популярным языком, что вся наука, представленная читателю, становится ясной и понятной, как дважды два — четыре. Желание хоть как-то откорректировать представление о воде, важнейшем теплоносителе, растворителе, главном материале нашего устройства, в основном потребляемом нами продукте в конце концов, посвящены две эти лекции.
§4
Продолжение, которое можно пропустить, не читая
Как уже видно из кратчайшего изложения канонической теории растворов, приведённой выше, любой раствор может рассматриваться как большая сложная система. Применение подходов теории БСС (больших сложных систем) к описанию может прояснить многие свойства водных растворов. Вторым краеугольным камнем нашего представления будет то, что вода сама по себе является раствором.
Идеальность же нашего представления будет заключаться не только в том, что мы будем рассматривать воду химически чистую, без примесей, но и в том, что вода эта будет водой изотопного состава Н2О16. Другие воды мы исключим из нашего рассмотрения, а это более 400 вод. Даже при таких драконовских ограничениях, максимально сжав радиус сферы познания, мы имеем объект изучения, порядками более сложный нежели известный всем "идеальный газ".
Рассмотрим, к слову, малоизвестные аспекты, связанные с идеальным газом. Эта тема раскрыта, например, у И.П. Базарова из МГУ. Речь идет вот о чём:
«…в идеальном газе каждая молекула движется по законам механики, но её поведение благодаря очень большому количеству взаимодействий с другими молекулами характеризуется качественно новой величиной — частотой того или иного механического состояния — одночастичной функцией распределения. Состояние большого числа частиц в целом (как и отдельной частицы) адекватно определяется функцией распределения…».
Целью любого исследования является установление адекватных изучаемому объекту параметров, определяющих его состояние и формулировку динамического закона изменения функций состояния.
Динамические законы вообще являются основными законами науки и их открытие составляет цель науки. Параметры, адекватно отражающие состояние системы, вводятся в физике не как самостоятельно определённые характеристики систем, а представляются через классические механические параметры (координаты, импульсы), которые не адекватно описывают немеханические объекты.
Вследствие этого состояние немеханических систем через механические параметры выражается вероятностно и обнаруживает статистические закономерности.
Известен с доаристотелевских времён, и самим же Аристотелем употреблённый, важнейший постулат теории БСС: "целое на части не делится". Считая целое ≡ БСС, получаем — характеристика свойств части целого не может точно отражать свойств всего целого, речь может идти только об обнаруженных статистических закономерностях.
Параметры же, полно отражающие состояние какого-либо объекта, определяются динамическими законами.
Соотношение между динамическими и статистическими закономерностями приводит к заключению о всеобщности однозначной детерминированности состояний всякой системы при одновременном существовании вероятностно- статистических связей. Изложенный подход позволяет по-новому прочитать философские категории необходимости, случайности и причинности. Здесь это рассматриваться не будет. Приведем лишь, без вывода, формулу, отражающую принцип дополнительности в статистической физике.
Как известно из квантовой физики сопряжённые величины находятся во взаимно-дополнительных отношениях: при точном значении одной величины дополнительная к ней другая величина не имеет определённого значения. Но дополнительность в статистической физике имеет отличие от квантовомеханической. Это обусловлено качественно-различной природой статистичности.
Итак, формула:
Δ(Р)Δ(V) < kT
где k - постоянная Больцмана.
§5
Современные представления структуры воды
Важнейшим новым и весьма современным представлением является понимание того факта, что жидкая вода является сложным раствором, состоящим из множества компонентов. Конечно же это представление появилось не сегодня. Всё началось с неизвестного ещё в ту пору (1892 г.) Вильгельма Конрада Рентгена. Была к той поре уже написана и диссертация Менделеева, но кто у нас читает диссертации? Тогда ведь русский язык тоже не был языком науки.
Конечно после присуждения В. К. Рентгену звания Нобелевского лауреата №1 по физике, написанные им статьи были прочитаны. В. К. Рентген предположил, что в жидкой воде должны присутствовать осколки ледяной структуры и с повышением температуры к пару их количество уменьшается.
Рентген позже увлёкся Х-лучами, а к намеченной, но брошенной им, теме подключилась огромная армия исследователей, создавшая горы познавательной литературы, изобилующей превосходными степенями: уникальная, аномальная, парадоксальная вода. Детали этого продвижения и имена участников (громкие и не очень) мы здесь пропустим и передадим их истории науки.
Что же сегодня известно? Рассмотрим 1Н2О16
Близкий к шаровой форме, атом кислорода шестнадцатого, про пространственную ориентацию которого нам не известно почти ничего, сильно искажается прильнувшими к нему двумя атомами водорода.
Поневоле вспоминаешь академика Грибова: «…не люблю я молекулы — кривые они очень!..». Шар становится похож на камень: есть две области пониженной плотности электронного облака и две, почти сросшиеся в одну, повышенной плотности электронного облака. Молекула стала уже чётко пространственно-ориентирована. Заметен и дипольный момент размером в 1 дебай. Но если заполнить такими камнями литровую банку, то при плотной упаковке весить она будет более одного килограмма восемьсот граммов. Значит есть ещё и то, о чём начал говорить В.К. Рентген.
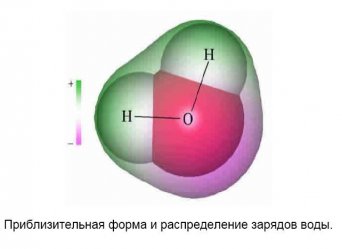
Понятие водородная связь было введено У. Родебушем в 1920 году для объяснения разрыхления воды. Суть в следующем:
Молекулы воды за счёт «дефектов» плотности электронных облаков взаимодействуют друг с другом, образуя вид связи отличный от ковалентного и чисто вандервальсового. Будучи всё же химической, водородная связь только лишь в 10% случаев приводит к обмену электронов разными молекулами. В остальных случаях молекулярные облака остаются строго индивидуальными, а связь имеет четко Кулоновскую природу. А коли так, то длина водородной связи так же не остаётся постоянной, а зависит от внешнего окружения. Не строго фиксируется и угол ~104 градуса. Поэтому различна энергия связи. К этому ещё предстоит вернуться. Но важно понять, принять и впредь не сомневаться:
Молекулы воды, объединённые водородной связью образуют энергоёмкий каркас, болтающийся среди молекулярной воды и себе подобных, составляя динамическую систему, полностью соответствующую понятию — раствор.
Реакция образования водородной связи — реакция экзотермическая, реакция распада водородной связи — реакция эндотермическая. Энтальпия этой реакции составляет по разным оценкам от 4 до 20 ккал/моль. Понятно, что для разрушения каркаса сцепившихся молекул, нужна энергия. Этой энергией является кинетическая энергия компонентов раствора, т.е. температура.
Обратите внимание на занимательную картинку: каркас массивнее в несколько, в сотню раз одиночной молекулы. Посмотрите на процесс присоединения одиночной молекулы к каркасу. Прилипающая к каркасу, возбуждённая в температурном смысле молекула, передает своё возбуждение каркасу, а тот в свою очередь возвращает его (возбуждение) в раствор остальным участникам. Температура раствора растёт. А стабильность каркаса уменьшается.
И обратный процесс (таяние льда) — испытывая лишнее, в энергетическом смысле, напряжение, каркас отбрасывает одну молекулу и становится в более выгодную в энергетическом плане позицию, он становится менее энергонасыщенным и более стабильным. А «температура» каркаса падает! И потребуется время, чтобы соседи набрали мощи и его вновь дообеспечили его энергией для последующего сброса лишнего.
Приведенная картинка прежде всего свидетельствует, что при таянии льда или распаде ассоциата, процесс освобождения молекул от ледяного осколка идёт ступенчато и пропорционально имеющемуся — т.е. экспоненциально!
N=N0e-λt
где λ = f(Т°)
Освободившаяся от связи молекула подчиняется известному закону — отсутствия последействия, т.е. она не помнит о своём прошлом! Здесь кроется радикальное отличие водородной от металлической связи.
В большинстве веществ молекулы удерживаются в узлах своих кристаллических структур вандервальвовыми или электрическими силами. В ассоциатах связь водородная – она значительно сильнее, а самое главное — она строго направленная! Это приводит к тому, что при плавлении льда ли, при отрыве от ассоциата ли, она рвётся только сразу. Водородная связь не может ухудшаться постепенно, прежде чем порвётся. Либо - либо.
Смотрите на кристалл большинства иных веществ при нагревании:
- Усиливается тепловое движение молекул,
- Молекулы начинают отклоняться от своего положения, разъезжаться из узлов всё дальше и дальше, но, внимание! связи сохраняются.
Что происходит с молекулой воды оторвавшейся от каркаса?
До отрыва молекула связана со своими соседями связями, ориентированными в строго определённую точку пространства. И если она оторвалась, то ориентиры потеряны, и возврата в прошлое положение нет! Оторванная молекула не может замкнуть свои два протона и два неподелённых электрона. Молекула воды, оторвавшись, порвала со своим прошлым сразу и бесповоротно.
Даже кажется, что и памяти у воды быть не может. Но выше уже говорилось, что отрыв одной молекулы приводит к повышению прочности остального каркаса. И не может быть такой энергии, что б разорвать все связи каркасного ассоциата разом! Только поэтому память и остаётся. Сравнивая процессы охлаждения (замерзания) и нагрева (таяния) мы видим, что продуктивность первого процесса выше, чем у второго. В первую очередь это связано с перераспределением внутренней энергии раствора. При охлаждении всего раствора ещё не вовлеченная в ассоциат молекула становится более подвижной и у неё больше шансов подскочить к ассоциату с «правильной» ориентацией.
В этом кроется разгадка известного эффекта Эрасто Мпемба — горячая вода замерзает быстрее холодной.
Создавая больший температурный градиент на границе системы, мы обрекаем раствор на большую скорость формирования структуры. Мы же часто видим в футболе, особенно в играх английской премьер лиги, как при равном профессионализме исход игры зависит (грубо) от подвижности игроков на поле.
Мне уже приходилось писать о теплогенераторе Потапова. Вот уж лучшего макета для демонстрации водородной связи и придумать нельзя. Закрученный в трубе поток воды, увеличивает давление в пристенных областях за счет силы инерции. Возникают условия для интенсивного роста каркасных ассоциатов в сжатом инерцией слое. Чем выше давление, тем больше становится каркасных ассоциатов, температура растёт вслед. На выходе из трубы вода перегрета сверх расчёта. Но дайте ей время, и она сама вернётся в исходное состояние, может быть даже став холоднее первоначальной. Всё зависит от тех тепловых потерь, какие она –вода - понесёт при течении по трубам.
Известна холодная резка металла и камня сверхсжатой (до 400 атм.) струёй воды.
Не становится ли Вам ясно, уважаемый читатель, за счёт какого абразива режет струя? А ведь этот абразив по происхождению родственник алмазной крошке... Понимание воды как раствора различных ассоциатов, длиной подчас до тысяч молекул, существенно облегчает понимание процесса резания, тем паче, что сходственный процесс – пескоструй - всегда можно посмотреть.
А помните вихревые нити Гельмгольца?
Не сможет ни один каркасный ассоциат в растворе быть неподвижным! Как уже было сказано выше: кривой он очень. Начав вращаться при оттаивании, он остановится только в одном случае — когда вновь замёрзнет! Видимо потребуется время на осознание того, что ламинарное течение - есть вырожденное состояние турбулентного, а не наоборот.
Об Эренфестовых масштабах и временах
Осталось понять, почему изложенное модельное представление столь долго к нам не приходило? Отвечу, памятуя Шопенгауэра, следовало подождать пока вырастет поколение знающее, что такое 25-й кадр. Мне могут возразить, что и две тысячи лет тому назад люди знали, что бесполезно, выступая перед толпой, говорить истину. Надо рассказывать притчи. Тогда кто-нибудь поймёт, или по крайней мере, запомнит изложенное. С притчами инженеру сложно, а вот поколению, посещавшему кинотеатры на премьеры Чапаева или Фантомаса, уже хорошо известно, что между кадрами на плёнке есть пробел, перемычка, граница между кадрами.
И от того насколько правильно на непрерывном процессе поставлены эти пробелы зависит понимание происходящего на экране. Первым в технике это понял и озвучил Пауль Эренфест.
Всякому явлению есть свой временной масштаб.
Рассмотрим временные масштабы жизни каркасных ассоциатов. Частота Дебая = 1013, значит время наблюдения одиночной молекулы воды (время жизни) =10-13 секунд, время жизни диполя = 10-12 секунд, время жизни случайного ассоциата =10-11 секунд, время жизни каркасного ассоциата =10-10 секунд.
Данные эти расчётные, следует читать их с точностью до порядка. Большая точность для понимания сегодня вряд ли потребна. Приведённые значения времён жизни ассоциатов прежде всего говорят о том, что без применения специальных методов их невозможно увидеть. Частота мерцания кадров в четыреста миллионов раз больше, чем на кинопленке. Но разглядывать их уже умеют. А люди столь же творческие сколь и маргинальные, рисуют картины более красивые, чем фуллерен 60.
Смотрите у Мартина Чаплина:
На приведенном рисунке молекулы представлены в виде шариков, что так же не верно. На самом деле подобная идеализация бесконечно далека от жизни.
На этапе услышанного и понятого очень сложно удержать себя от попыток упрощенной математической формализации динамического процесса в нашем растворе. Собственно, это обстоятельство и послужило тормозом развития теории воды по Рентгену. Прагматичное желание последователей, подхвативших саму идею осколков, наворочать формул с линейными (или эспоненциальными) зависимостями, завело красивую идею в тупик.
Вернемся к идеализации, изображенной на первом рисунке, о распределении зарядов в молекуле воды. Следует ещё раз подчеркнуть, что водородная связь имеет главным образом Кулоновскую природу. К сегменту высокой плотности электронов, занимающему 90 градусов, примкнуть удаётся обыкновенно двум протонам соседней молекулы. Но всегда могут быть примыслены условия, когда этих протонов может быть и один, и три, а возможно и больше. Всё зависит от соседей, их положения в пространстве, заряда, расстояния.
У Валерия Брюсова в его стихотворении «Мире электрона» читаем:
Там всё, что здесь в объёме сжатом,
Но также то, чего здесь нет.
Их меры малы, но всё та же их бесконечность как и здесь;
Там скорбь и страсть как здесь, и даже Там та же мировая спесь.
Искушение процитировать полностью велико, но пора и честь знать.
При большем количестве протонов (скажем три на один кислород) увеличится длина связи и уменьшится её прочность. В совершенно определённых пределах, энергия связи и её длина - вещи настолько взаимосвязанные, что термины можно считать синонимами.
§6
О внутренней энергии
Рассмотрим некий элементарный объём воды вне каких-либо внешних воздействий в условиях жидкой воды при давлениях близких к атмосферному. Полная внутренняя энергия этого объёма состоит из кинетической энергии Uкин. молекул, энергии связи молекул в ассоциатах Uсв., и, собственно, внутренней энергии молекулярной воды Uмол., включающая химическую, атомную и ядерную составляющие. Обозначая Евн. - полную внутреннюю энергию, можем записать:
Uкин. + Uсв. + Uмол.= Евн. (1)
Uмол. - при условиях нашего рассмотрения величина неизменная, как и Евн., поэтому можем записать:
Uкин. + Uсв.= Const (2)
Как видно было ранее из нашего рассмотрения частоты изменения Uкин. и Uсв. настолько велики, что можно полагать эти функции непрерывными.
Продифференцировав выражение (2) по времени Т имеем:
dUкин./dТ = -dUсв./dТ (3)
Uкин. — кинетическая энергия молекул, из курсов физики =1/2 mмv2 m =3/2 kT
Uсв. — энергетический запас аккумулированный во временных, каркасных и прочих ассоциатах, образованных водородными связями.
Обозначим Qмоль количество энергии, которым обладает 1 моль воды структурированной воды за счёт водородной связи. По разным данным это от 4 ккал до 20 ккал на моль.
Тогда энергия, приходящаяся на одну молекулу равна Qмоль/Nавогадро. Безусловно речь идёт о средних значениях.
Запишем это в виде формулы: 3/2 kdT/dТ = -Qмоль/Nавогадро dN/dТ, сгруппировав постоянные коэффициенты имеем: dT/dТ = -СdN/dТ или
dT/dТ + СdN/dТ = 0 (4),
где С = 3/2 k Nавогадро / Qмоль
§7
Анализ полученного результата
dT/dТ + СdN/dТ = 0
Нами получено важнейшее уравнение, отражающее динамические процессы, происходящие в элементарном объёме чистой воды.
Важно осознавать, что процессы эти:
- Непрерывны,
- Постоянны,
- Обратимы.
В элементарном объёме чистой воды всегда идёт процесс поддержания динамического равновесия между компонентами, составляющими саму воду. Этот процесс чутко реагирует на малейшие изменения внешних воздействий. (10-13 сек.), например, на действие консервативных сил.
Внедрение же в рассматриваемую нами воду скажем 1 атома благородного газа уже меняет равновесие — это другой! раствор. Не повторяйте ошибок Прандтля! Становится понятно, что физические свойства двух вод: охлажденной до температуры Т= Х0 и нагретой до той же температуры при одном и том же давлении — разные, но стремящиеся к одинаковому значению. А вот время сближения значений зависит от множества факторов!
И с этим ещё предстоит разобраться…
Библиография
- «Айрес», фонд развития новых медицинских технологий, материалы сайта www.aires.spb.ru, 2005
- Высоцкий В.И., Корнилова А.А. Физические основы долговременной памяти воды. - Вестник МГУ, серия 3, Физика, 2004, №3
- Ефимов Ю.Я. Симметричны ли молекулы Н2О в жидкой воде? - Институт химической кинетики и горения СО РАН, Новосибирск, Электронный журнал «Исследовано в России», http://zhurnal.ape/relarn/ru/articles/2001/123.pdf
- Зеленин Ю.М. Двухкомпонентная модель структуры воды. - Электронный научный журнал «Исследовано в России», http://zhurnal.ape.relarn.ru/articles/2005/110/pdf
- И. де-Бур. Теория жидкого состояния. -Успехи физических Наук, том LI, вып. 1, 1953
- Карапетьянц М.Х., Дракин С.И. Общая и неорганическая химия. - Учебник, 3-е изд., М., Химия, 1994
- Малафеев Н.Т. О природе возникновения изогнутых связей в воде. - Письма в ЖТФ, том 29, вып. 1, 2003
- Слесарев В.И., Шабров А.В. Влияние структуры воды на её статические и динамические свойства. - Вестник СПб ГМА им. Мечникова, 2000
- Справочное руководство «Химия» под ред. Г. Койне, Л., Химия, 1978
- Стебновский С.В. О сдвиговой прочности структурированной воды. - Журнал Технической Физики, том 74, вып. 1, 2004
- Стебновский С.В. Журнал Технической Физики. - 2002, том 72, вып.11, с. 24-27
- Френкель Я.И. Теория жидкого состояния. - Издательство «Правда», М., 1948
- Цирельсон В.Г. Химическая связь и межмолекулярные взаимодействия. - Конспект лекций по квантовой химии, РХГУ им. Д.И.Менделеева, М., 2004
- Шапошник В.А. Анализ температурной зависимости вязкости воды. - Вестник ВГУ, Воронеж, №1, 2004, с. 107-109



