Лекция I. Физика воды для инженеров и механиков
Современному человеку простая вода уже не кажется совсем простым веществом. А уровень фонового шума, поднимаемого жёлтой прессой и шарлатанами всех мастей, рассуждающих о паранормальных свойствах, существенно влияет на соответствие взглядов специалистов современным естественно-научным представлениям о воде. Желание хоть как-то откорректировать представление о воде, важнейшем теплоносителе, растворителе, главном материале нашего устройства, в основном потребляемом нами продукте в конце концов, посвящены две эти лекции.
Введение
Воды состава Н2О и только в природе не бывает. Как нет и чистой воды.
Природная вода не бывает совершенно чистой. Наиболее чистой является талая и дождевая вода, но и она содержит незначительные количества различных природных примесей. Количество примесей в пресных водах находится в пределах от 0,01 до 0,1% (масс.). Морская вода содержит 3,5% (масс.) растворённых веществ, главную массу которых составляет обыкновенная поваренная соль.
Вода, содержащая значительное количество солей кальция и магния, называется жёсткой в отличие от мягкой воды - дождевой. Жёсткая вода уменьшает процесс пенообразования, а на стенках котлов образует накипь. Чтобы очистить природную воду от взвешенных в ней частиц, ее фильтруют сквозь слой пористого вещества, например, активированного угля, керамзита, обожжённой глины и др.
Если подсчитать все возможные нерадиоактивные соединения с общей формулой Н2О, то общее количество возможных изотопных модификаций воды всего девять (так как существует два стабильных изотопа водорода и три — кислорода):
• Н216O − лёгкая вода, или просто вода
• Н217O
• Н218O − тяжёлокислородная вода
• HD16O − полутяжёлая вода
• HD17O
• HD18O
• D216O − тяжёлая вода
• D217O
• D218O
С учётом трития их число возрастает до 18:
• T216O — сверхтяжелая вода
• T217O
• T218O
• DT16O
• DT17O
• DT18O
• HT16O
• HT17O
• HT18O
Таким образом, кроме обычной, наиболее распространённой в природе «лёгкой» воды 1H216O, в общей сложности существует 8 нерадиоактивных (стабильных) и 9 слаборадиоактивных «тяжёлых вод».
Всего же общее число возможных «вод» с учётом всех известных изотопов водорода (7) и кислорода (17) формально равняется 476. Однако распад почти всех радиоактивных изотопов водорода и кислорода происходит за секунды или доли секунды (важным исключением является тритий, период полураспада которого более 12 лет). Например, все более тяжёлые, чем тритий, изотопы водорода живут порядка 10−20 с; за это время никакие химические связи просто не успевают образоваться, и, следовательно, молекул воды с такими изотопами не бывает. Радиоизотопы кислорода имеют периоды полураспада от нескольких десятков секунд до наносекунд. Поэтому макроскопические образцы воды с такими изотопами получить невозможно, хотя молекулы и микрообразцы могут быть получены. Интересно, что некоторые из этих короткоживущих радиоизотопных модификаций воды легче, чем обычная «лёгкая» вода (например, 1H215O). У каждой из этих вод СВОИ физико-химические свойства!
Например, температура плавления у D2O +3,81° C, а у Т2О +9° C. А температура кипения у D2O +101,43° C, у Т2О +104° C.
На этапе вступления в тему здесь нам следует остановиться. Постараемся понять из написанного, что наша чистая вода — это сложный раствор, состоящий из множества вод и примесей. И знания о воде могут быть сформированы в наших головах только с использованием элементарной теории растворов. О теории растворов мы и поговорим.
Часто получается, что лучше Ричарда Фейнмана сказать в физике ничего лучше нельзя, поэтому далее цитата:
«<…> я все же учёл интересы и такого парня, которого все эти фейерверки мыслей и многосторонние приложения могут только встревожить и отпугнуть, от кого вообще нельзя ожидать, что он усвоит большую часть материала. Я хотел, чтобы для него в лекциях оказалось по крайней мере основное ядро, или костяк того, что он может получить. Я надеюсь, что он не очень будет нервничать, если не поймет в лекции всего. Пусть не понимает всего, пусть ухватит только самую суть, самое бьющее в глаза. Конечно, и для этого он должен проявить некоторую сообразительность, должен захотеть понять, какие теоремы и представления являются самыми главными, а что он сможет понять только позже и пока оставляет в стороне».
§1
Элементы теории растворов. Понятие о растворах
Раствором называется гомогенная смесь, состоящая из двух и более числа веществ, состав которой может непрерывно изменяться в пределах области растворимости.
Растворы являются системами, в которых имеют место различные виды взаимодействия между частицами (водородные, электростатические, Вандервальсовы и прочие). Принято считать, что истинный раствор образован частицами меньше 1 нм.
От чисто химических соединений растворы отличаются переменностью состава и характером сил связи (Вандервальсовые взаимодействия, водородная связь, вторичное химическое взаимодействие). Изменение состава раствора может происходить с выделением или поглощением тепла.
Компоненты, при смешении которых получается раствор, изначально могут находиться в различных агрегатных состояниях.
Образующиеся растворы так же могут быть твердыми, жидкими и газообразными.
Наиболее распространенным типом раствора является жидкий раствор. Все растворы являются постояннодействующими динамическими системами.
Состав раствора количественно может быть выражен различными способами: либо в безразмерных относительных величинах (в долях единицы или в процентах), либо в размерных величинах — концентрациях (молярности, моляльности, массовом содержании). Следует понимать, что концентрация – это непрерывно-изменяющаяся функция состояния.
Экстенсивные свойства растворов – свойства, не зависящие от количества, относят обычно к раствору в целом. А для оценки вклада некоего компонента в то или иное экстенсивное свойство используют парциальные мольные величины.
§2
Изотонический коэффициент Вант-Гоффа
Если в растворителе, состоящем из N1 частиц, полностью растворяется N2 частиц некоего вещества, то общее число гомогенных частиц в растворе вовсе не обязательно равно сумме N1 + N2.
Частицы N2 могут самопроизвольно распасться на ионы. Этот процесс носит название электролитическая диссоциация и количественно характеризуется степенью диссициации α. Вещества, полностью распавшиеся на ионы, относят к сильным электролитам. Вещества, распадающиеся на ионы крайне незначительно, - к слабым электролитам. У неэлектролитов степень диссоциации равна нулю. Общее число частиц в растворе в таком случае возрастает.
Существуют процессы и противоположного плана. Часть частиц N2, попав в растворитель, за счет неких взаимодействий с молекулами растворителя, образует новый вид частиц, иногда называемых ассоциатами, объединяющими несколько молекул растворителя и частицу N2. Общее число частиц в растворе в таком случае уменьшается. Этот процесс носит общее название сольватация, а для водных растворов - гидратация.
Отношение общего числа частиц в растворе к числу введенных в него молекул растворённого вещества называется изотоническим коэффициентом Вант-Гоффа "i".
§3
Коллигативные свойства растворов
Коллигативными называются такие свойства растворов, которые зависят только от концентрации, но не от природы растворённых веществ.
К таким свойствам относится изменение температуры кипения и замерзания, а также осмотическое давление.
Рассмотрим их по порядку.
1. Изменение температуры кипения
Процесс парообразования, происходящий не только со свободной поверхности жидкости, но и внутри её, называется кипением.
Температура, при которой давление паров жидкости над жидкостью равно внешнему давлению называется температурой кипения. Температура кипения идеального раствора тем выше температуры кипения чистого растворителя, чем больше концентрация растворённого вещества. Зависимость температуры кипения от концентрации принято представлять линейной, а коэффициент пропорциональности между приращением температуры кипения "ΔΤ" и моляльной "m" (моль/кг растворителя) концентрацией раствора принято называть эбулиоскопической постоянной растворителя "E".
ΔΤ=Em
Эбулиоскопическая постоянная растворителя не зависит от природы растворённого вещества. Для воды она равна 0,513.
Соответственно для растворов электролитов следует записать:
ΔΤ=Eim
где i - изотонический коэффициент Вант-Гоффа.
Для растворов сильных электролитов изотонический коэффициент должен был бы быть равным числу частиц, на которые распадаются молекула при диссоциации. Но этого не происходит из-за электростатического взаимодействия между ионами в растворе сильного электролита. Число частиц на которые распадаются молекула при диссоциации - ν фактически для сильных электролитов всегда больше изотонического коэффициента - i. Отношение изотонического коэффициента к числу частиц, на которые распадаются молекула при диссоциации называется осмотическим коэффициентом – g.
g = i/ν
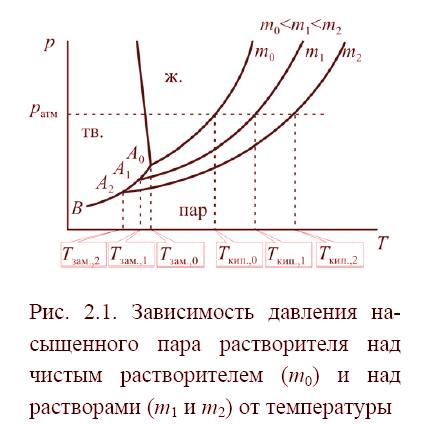
Для бесконечно разбавленных растворов i=ν, g=1.
Эбулиоскопическая постоянная может быть выражена через удельную теплоту испарения чистого растворителя Δhисп. 0 и его температуру кипения Ткип. 0:
Е = R * Ткип. 0/1000 * Δhисп. 0
2. Понижение температуры замерзания
Вторым коллигативным свойством растворов является понижение температуры замерзания.
Условием замерзания является равенство давлений насыщенного пара растворителя над кристаллами растворителя и раствором. Из анализа приведённой выше диаграммы видно, что температура замерзания раствора ниже температуры замерзания чистого растворителя.
Понижение температуры замерзания пропорционально моляльной концентрации раствора - m.
Оно выражается для растворов неэлектролитов уравнением:
ΔТ=Кзамер?m
а для растворов электролитов уравнением:
ΔТ=Кзамер?im
В этих уравнениях Кзамерзания — криоскопическая постоянная Кзамерзания = 1,86
Известно уравнение:
Кзамер. = RT2 ам. 0 /1000Δh
здесь Δhпл. 0 - удельная теплота плавления чистого растворителя.
3. Осмотическое давление
Осмосом называется явление проникновения растворителя в раствор через некую полупроницаемую мембрану, т.е. такую мембрану, через которую может проникнуть растворитель и не может проникнуть растворённое вещество. Как оказывается вся окружающая нас живая природа, да и мы сами переполнены такими мембранами, ибо оболочки всех животных и растительных клеток и есть упомянутые мембраны.
Осмос вызывается уменьшением химического потенциала растворителя при повышении концентрации растворённого вещества. И если мембрана находится между растворами разных концентраций, то возникает перетекание растворителя из области меньшей концентрации в область большей до тех пор, пока не выровняются концентрации растворённого вещества.
Остановить перетекание можно создав над областью большей концентрации избыточное гидростатическое давление. Давление, которое следует создать над раствором большей концентрации для предотвращения осмоса, называется осмотическим давлением и измеряется в единицах давления.
Согласно уравнению Ван-Гоффа это давление пропорционально температуре и градиенту концентрации растворённого вещества:
P=ΔCRT
где R = 8,314 Дж/(моль К),
Т - температура в o Кельвина,
С - концентрация в моль/м3,
Р - осмотическое давление в Па.
Явление т. н. обратного осмоса возникает при искусственном превышении давления более осмотического.
Осмотические явления ответственны за важнейшие биологические процессы (плазмолиз, тургор, изоосмию, лизис (биолог.)). На этих процессах мы здесь останавливаться не будем. Рассмотрим лишь одно из технических приложений описываемого явления.
Это гидроэлектростанция в г. Тофте близ Осло (Норвегия), работающая с ноября 2009 года за счет осмотического давления воды.
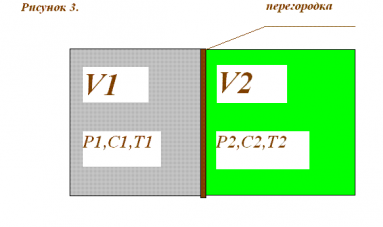
Принцип работы гидроэлектростанции
Морская вода с концентрацией соли С1 поступает в ёмкость V1 при Т1. Через полупроницаемую перегородку ёмкость морской воды примыкает к ёмкости V2 пресной воды с параметрами С2, Т2. Полупроницаемая перегородка пропускает воду в любом направлении и не пропускает соль. Поскольку перегородка не является препятствием для движения воды идёт процесс выравнивания концентрации соли в обоих объёмах, т.е. вода из пресного объёма поступает в морской объём повышая в нём соответственно давление. Повышенное в ёмкости с морской водой давление, другими словами гидростатический напор, и является характеристикой той потенциальной энергии, которая срабатывает в гидравлической турбине. Перспективы подобных электростанций ограничены технологическими возможностями производства полупроницаемых мембран. По мнению ряда аналитиков потребуется не менее десяти лет (с 2008 г.) для создания приемлемых технологий и производств этого вида оборудования.
Библиография
- Сайт фонда развития новых медицинских технологий «Айрес», материалы сайта, 2005 - . – Режим доступа: www.aires.spb.ru, свободный. – Загл. с экрана.
- Высоцкий, В. И. Физические основы долговременной памяти воды / В. И. Высоцкий, А. А. Корнилова // Вестник МГУ. Серия 8. Физика. – 2004. – Вып. 3.
- Ефимов, Ю. Я. Симметричны ли молекулы Н2О в жидкой воде? [Электронный ресурс] / Ю. Я. Ефимов // Институт химической кинетики и горения СО РАН. – Новосибирск. – Электронный журнал «Исследовано в России». – Режим доступа: http://zhurnal.ape/relarn/ru/articles/2001/123.pdf
- Зеленин, Ю. М. Двухкомпонентная модель структуры воды [Электронный ресурс] / Ю. М. Зеленин // Электронный научный журнал «Исследовано в России». – Режим доступа: http://zhurnal.ape.relarn.ru/articles/2005/110/pdf
- де-Бур, И. Теория жидкого состояния / И. де-Бур // Успехи физических наук – 1953. – Том LI. – Вып. 1.
- Карапетьянц, М. Х. Общая и неорганическая химия / М. Х. Карапетянц, С. И. Дракин. – М.: Учебник. – Химия. – 3-е изд. – 1994.
- Малафеев, Н. Т. О природе возникновения изогнутых связей в воде / Н. Т. Малафеев // Письма в ЖТФ. – Т. 29. – Вып. 1. – 2003.
- Слесарев, В. И. Влияние структуры воды на ее статические и динамические свойства / В. И. Слесарев, А. В. Шабров. – Вестник СПб ГМА им. Мечникова. – 2000.
- Справочное руководство «Химия» / под ред. Г. Койне. – Л. – Химия. – 1972.
- Стебновский, С. В. О сдвиговой прочности структурированной воды / Стебновский С. В. // Журнал Технической Физики. – Т. 74. – Вып.1. – 2004.
- Стебновский, С. В. / Журнал Технической Физики. – Т. 72. – Вып.11. – с. 24-27. – 2002.
- Френкель, Я. И. Теория жидкого состояния / Я. И. Френукль. – М.: Изд-во Правда, 1948.
- Цирельсон, В. Г. Химическая связь и межмолекулярные взаимодействия / В. Г. Цирельсон // Конспект лекций по квантовой химии, РХГУ им. Д. И. Менделеева. – М. – 2004.
- Шапошник, В. А. Анализ температурной зависимости вязкости воды / В. А. Шапошник // Вестник ВГУ. – Воронеж. – Вып. №1. – 2004. – с.107-109.



